Моделирование равновесия в системах химических реакций
Значительная часть химических реакций, составляющих основное содержание технологических процессов в цветной металлургии, являются обратимыми. Рассмотрим пример обратимой химической реакции:
А + 2В ![]() 2С.
2С.
Равновесие в такой химической реакции достигается при определенных значениях активностей участвующих веществ. Если эти вещества находятся в растворе, а их концентрации невелики (разбавленные растворы), то с некоторым приближением вместо величин активностей можно использовать величины концентраций. Равновесие в химической реакции характеризуется величиной константы равновесия:
![]() .
.
Величина константы равновесия связана с изменением энергии Гиббса и может быть рассчитана по термодинамическим данным участвующих веществ:
![]()
где ΔGT- изменение энергии Гиббса для данной химической реакции, Т – температура, R- универсальная газовая постоянная.
Рассчитав величину константы равновесия для химической реакции, идущей при заданной температуре, можно определить соотношение концентраций исходных веществ и продуктов, которое установится при достижении равновесия.
Несколько более сложно определить равновесный состав системы, в которой одновременно происходит несколько обратимых химических реакций. Рассмотрим следующий пример. Пусть имеется система обратимых химических реакций с участием веществ А, В, С и D. В данной системе вещество А последовательно и обратимо превращается в вещество С, предварительно образуя В. Возможен и параллельный путь: вещество А параллельно с образованием В разлагается с образованием D. При заданных условиях (температуре, давлении) в системе установится равновесие и будут достигнуты равновесные концентрации веществ.
Для расчета равновесных концентраций запишем выражения для констант равновесия всех реакций через равновесные концентрации:
![]() А
А ![]() В
В ![]() ;
; ![]()
В ![]() С
С ![]() ;
; ![]()
А ![]() D
D ![]() ;
; ![]() .
.
Пусть в начальный момент отсутствуют промежуточные вещества В и С, а также конечный продукт D:
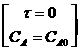 ; СВ0=0; СС0=0; CD0=0.
; СВ0=0; СС0=0; CD0=0.
Значения констант равновесия рассчитаем для каждой из реакций по термодинамическим данным: ![]() . Таким образом, величины констант равновесия будем считать известными величинами.
. Таким образом, величины констант равновесия будем считать известными величинами.
На единицу объёма данной системы СА0 – СА представляет собой количество израсходованных молей компонента А. В соответствии со стехиометрией химических реакций и законом сохранения вещества, убыль массы А равна сумме масс образующихся веществ B,C и D, что можно выразить уравнением:
СА0 – СА = CB + CC + CD.
Преобразуем уравнение к следующему виду:
CA0 = CA + CB + CC + CD,
И подставим в правую часть выражения для соответствующих концентраций веществ:
CA0 = CA + k1CA + k1k2CA + k3CA.
Сгруппируем однородные члены уравнения
CA0 = CA(1 + k1 + k1k2 + k3)
и получим выражение для равновесной концентрации СА
![]() .
.
Равновесные концентрации других веществ легко определить, поскольку значения всех констант равновесия нам известны из предыдущего расчета, а выражения содержат CA.
При расчётах равновесий в системах химических реакций необходимо знать kр каждой реакции, начальный состав системы – это даёт возможность рассчитать равновесный состав системы.
Реальные задачи расчёта равновесного состава систем намного сложнее: уравнения в этих задачах нелинейны; требуется учесть, что компоненты, входящие в реакцию находятся в разных фазах; вместо концентраций корректно использовать значения активностей компонентов. Практический смысл расчёта равновесий в таких сложных системах сводится к тому, что расчётный равновесный состав системы является тем физико-химическим пределом, до которого может дойти реальный процесс, если для его осуществления отведено неограниченное время.


