Основы электролиза криолитоглиноземиых расплавов
Производство алюминия основано на электрохимическом разложении глинозема, растворенного в криолитовом расплаве. Можно поставить два вопроса:
почему нельзя разлагать электролизом водные растворы солей алюминия, например нитраты, сульфаты и т.д;
почему не производить алюминий так же, как получается железо в печах при восстановлении оксидов, например по реакции
Fe2O3 + ЗС = 2Fe + ЗСО. (1)
Ответ на них дает второй закон термодинамики. Согласно этому закону вещества обладают особым внутренним энергетическим свойством (энергией Гиббса G), которое можно при электролизе изменить (увеличить), только совершив электрическую работу. Такая связь описывается уравнением
-ΔG = А*Q = Е°* z*F, (2)
где А — электрическая работа; Q — количество электричества; Е° — равновесная ЭДС; г — число электронов, участвующих в реакции; F — число Фарадея (96484 Кл/моль).
Величина Е° при разложении воды на водород и кислород при 25 °С составляет 1,229 В, тогда как реакция разложения
А12О3 = 2А1 + 1,5О2
требует ЭДС, равной 2,991 В. В этих условиях протекание тока приведет к осуществлению реакции с меньшим изменением энергии Гиббса (с меньшей ЭДС), т.е. к разложению воды.
Второй закон термодинамики утверждает, что система переходит самопроизвольно из первого состояния во второе, если во втором состоянии энергия Гиббса меньше, чем в первом. Между тем для реакции с использованием самого дешевого восстановителя — углерода
1-е состояние 2-е состояние
А12О3 + ЗС = 2А1 + ЗСО (3)
разница между энергиями Гиббса второго и первого состояний при достаточно высокой температуре 1000 °С (1273 К) составляет + 1090 кДж, и только при очень высоких температурах (более 2000 °С) разность становится отрицательной. Но при такой температуре резко увеличиваются эксплуатационные затраты, связанные с коррозией и износом оборудования. Вот почему промышленные способы термического получения алюминия до сих пор не разработаны, хотя попытки это сделать не прекращаются и поныне.
1.1. Электрохимический эквивалент — это число, показывающее, сколько граммов вещества выделяется на электроде (катоде или аноде) при протекании электродной реакции в расчете на единицу количества электричества (кулон или ампер • час). Рассмотрим способ его определения на примере реакций, протекающих на катоде и аноде алюминиевого электролизера.
В упрощенной форме основная катодная реакция присоединения электронов (восстановления) имеет вид
А13+ + 3е = А1. (4)
Уравнение (4) написано для отдельного атома. Умножим правую и левую части (4) на число Авогадро (число атомов и грамм-моле, N). Тогда количество веществ окажется выраженным в грамм-молях (М). Произведение е*N = F носит название числа Фарадея. Подставив величину заряда электрона (1,6*10-19 Кл) и числа Авогадро (N = 6,023 • 1023 моль-1), получим F = 96486 Кл ■ моль-1 (или 26,8 А • ч • моль-1). Тогда уравнение для расчета электрохимического эквивалента К будет иметь вид
К = М/3 • F. (5)
Подставив значение М = 26,97 г • моль 1 и F = 26,8 А • ч • • мель ~1 для восстановления трехвалентных ионов алюминия, получим К = 0,3354 г/ (А • ч).
В упрощенной форме анодная реакция примет вид
2О2- - 4е + С = СО2. (6)
Рассуждая аналогично, получим электрохимический эквивалент для углерода К - 12/4 • 26,8 = 0,112 г/(А • ч), для СО2 К = 36/4 • 26,8 = 0,336 г/(А • ч) и для кислорода К = 32/4 • 26,8 = 0,299 г/(А • ч).
1.2. Выход по току. Из размерности электрохимического эквивалента следует, что он определяет количество вещества Рт, получающегося при пропускании через электрод единицы количества электричества (ампер-часа или кулона). Чтобы рассчитать массу для случая произвольного количества электричества Q, надо электрохимический эквивалент К умножить на это количество электричества. Тогда получим;
Рт = К*Q = К* I*t, (7)
где I — сила тока; t — время.
Например, при / = 200 кА и t = 24 ч (т.е. сутки) имеем Рт = 0,3354*200•24 = 1612,8 кг/сут. На практике данная масса металла Рп отличается от теоретически рассчитанной.
Это отношение
η = Рп/Рт (8)
(где Рп — масса, определенная взвешиванием) называется выходом по току. При промышленном электролизе выход по току меньше единицы, и практически полученная масса с учетом (7) находится по уравнениюj
Рп = V К- I t. (9)
В промышленном электролизе выход по току зависит от множества факторов и составляет от 0,88 до 0,96.
1.3. Состав электролита. Расплавленный криолит (Na3AlF6), являющийся хорошим растворителем глинозема, — главный компонент электролита. Для снижения температуры начала кристаллизации и улучшения других свойств электролита (о чем подробнее будет изложено далее) в расплав. Водятся добавки, в частности соли или оксиды кальция, Магния и лития, а также фторид алюминия. Естественно, что в состав электролита входит и глинозем (от 1 до 8 % (по Массе)).
1.4. Устройство электролизера. Электролизер включает следующие основные блоки: 1 — катодное устройство, где протекает электролиз; 2 — анодный узел, где на подошв угольного анода происходит выделение анодных газов (реакция (6)); 3 — систему подвода тока (ошиновка); 4 — систему Ьиоотсоса. Схемы основных двух типов ванн: с самообжигающимся анодом (анодом Содерберга) и предварительно обож-Ьенным анодом (ОА) представлены на рис. 2.1 и 2.2 [3]. I Катодное устройство размещается в стальном кожухе длиной 9—14 м, шириной 3—4,5 м и высотой 1—1,2 м. Кожух футеруется теплоизоляционными и затем огнеупорными материалами. Внутренняя часть катодного устройства выкладывается угольными блоками. Заделанные в нижние (подовые) блоки стальные стержни служат для отвода тока.
Анодный узел включает собственно угольный анод (со стальной рубашкой для анода Содерберга) и систему сталеалюминиевых токоподводов. Постоянное напряжение поддерживается за счет перемещения анода домкратами, опускающими или поднимающими анодную раму, к которой зажимами крепятся анодные токоподводы.
В общую цепь (серию) последовательно включается 150— 200 электролизеров, которые соединяются ошиновкой. Напряжение на ванне в зависимости от типа и конструкции меняется от 3,9 до 4,5 В.
Анодные газы на электролизерах с верхним токоподводом (ВТ) собираются в газосборном колоколе, укрепленном по периметру анодной рубашки (см. рис. 1). В этом случае предусматривается частичное дожигание оксида углерода и смолистых веществ, выделяющихся при коксовании анода, в специальных горелках, смонтированных вместе с газосборным колоколом.
1.5. Электролиз. Электрический ток, проходя через электроды и электролит, выделяет на катоде алюминий (а в небольшом количестве в сплаве с ним натрий и кальций), а на аноде — диоксид углерода СО2. При этом полная электрическая работа А определяется выражением
А = U*I*t, (10)
где U — напряжение.

Рис. 2.7. Принципиальная схема электролизера с анодом Содерберга. 1 — газосборный колокол; 2 — анодные штыри; 3 — анодная масса; 4 -электролит; 5 — настыль; 6 — блюмсы; 7 — угольная подина; 8 — катодный кожух; 9 — огнеупоры и теплоизоляция.

Рис. 2.2. Схема электролизера с обожженными анодами.
1 — катодное устройство; 2 — анодные блоки; 3 — токоподводящая штанга; 4 — газосборное устройство; 5 — анодная ошиновка.
Отношение затраченной энергии (10) на количество проишеденного металла (8) называется удельным расходом шнергии W (кВт • ч/кг), который равен
W = U/k * η = U/0,3354η = 2,98 U/η. (11)
Величина W может составлять от 12,6 до 17,0 кВт • ч/кг А1 в зависимости от напряжения и выхода по току, которые обусловлены типом электролизера, силой и плотностью тока, составом электролита и другими параметрами.
На поверхности электролита образуется корка, которую приходится пробивать, чтобы загрузить глинозем. Существуют несколько способов загрузки. Наиболее современный способ предполагает расположение пробойников и бункеров с дозаторами вдоль продольных сторон для ванн с анодом Содерберга или по центру ванны с обожженными анодами. Одна система пробойник—дозатор устанавливается в расчете приблизительно на 40 кА тока. Частота загрузки 1—2 мин при до:»е, меняющейся от 200 г до 1 кг. Диаметр загрузочного отверстия в корке при этом составляет около 15 см.
На некоторых заводах используется загрузка, основанная М» разрушении корки вдоль всей продольной стороны ванны Или ее части. С помощью балки, закрепленной на ванне и приводимой в движение пневмоцилиндрами, корка со слоем глинозема толщиной около 10 см продавливается с шириной канала, равной примерно 20 см. При этом в ванну попадает приблизительно 40 кг глинозема в расчете на погонный метр канала. Такими же параметрами характеризуются и другие системы пробивки напольно-рельсовые машины с фрезой как рабочим органом, а также дизельные машинки, снабженные пневмопробойником. Недостатком систем с разрушением корки является попадание в расплав столь большого количества глинозема, что зачастую он не успевает полностью раствориться, уходя под металл и образуя осадок, осложняющий работу ванны.
Важная особенность электролизера — его дифференцированная теплоизоляция. Хорошо утепленная подина должна исключать кристаллизацию электролита и глинозема (появление "коржей"), которые становятся причиной многих технологических осложнений: повышение омического сопротивления из-за низкой проводимости твердого электролита, неравномерность тока в подине, появление горизонтальных токов в металле, вызывающих его интенсивную циркуляцию, и т.д. Поскольку подовые блоки имеют пористость около 20 % и эти поры заполнены электролитом, а солевой расплав хорошо смачивает углерод, получается, что металл снизу находится в некотором электролитном "чулке". Малая теплоизоляция вдоль бортов с угольными блоками (200 мм) или блоками из карбида кремния (50—70 мм) приводит к тому, что вдоль бортов как в электролите, так и в зоне металла существуют настыли, состоящие в основном из твердого криолита. Однако между настылью и металлом, высота (уровень) которого составляет от 15 до 45 см в зависимости от типа электролизера, существует слой жидкого электролита толщиной несколько менее 1 мм. Этот слой поддерживает связь между основным объемом электролита и электролитом, находящимся под металлом. Настыль играет важную роль в работе ванны:
- защищает блоки от разрушения; растворенный в электролите или жидкий металлический алюминий реагирует с углеродом с образованием карбида (А14С3), который растворяется в электролите. Настыль является единственной надежной защитой бортовых блоков;
- служит естественным регулятором температуры электролиза. При повышении температуры настыль растворяется, что приводит к уменьшению теплового сопротивления, увеличению тепловых потерь и падению температуры (рис. 3). Перегрев электролита и увеличение коэффициента теплообмена на границе электролит—настыль или металл—настыль снижают толщину настыли. Именно этим объясняется тот факт, что в этом районе всегда наблюдается самая тонкая настыль; растворение настыли или ее кристаллизация — одна из главных причин изменения состава электролита; 4) надлежащая настыль формирует форму рабочего пространства (ФРП), определяет небольшую скорость циркуляции Металла, при которой достигается высокий выход по току.
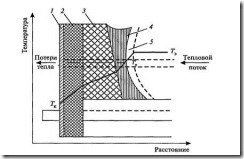
Рис. 2.3. Стационарный тепловой поток через бортовую стенку. / — кожух; 2 — теплоизоляция; 3 — бортовой блок; 4 — настыль; 5 — пограничный слой электролита; Тк — температура кожуха; Т„ — температура ликвидуса; Тэ — температура электролита.
Одним из жестких требований к современному электролизу является поддержание определенного расстояния анод—катод (МПР). Обычно МПР составляет 5—6 см, и каждый из них "стоит" приблизительно 350 мВ падения напряжения в электролите. Однако эти цифры не отражают особенностей технологии и всегда приходится доказывать необходимость даже очень небольшого уменьшения МПР (зажатия ванны) или, наоборот, ее разжатия. Грамотный специалист понимает, что Попытка необоснованно снизить МПР обязательно приведет к усилению волнообразования (потере устойчивости), а в конечном итоге — к снижению выхода по току. Увеличение МПР, повышая выход по току, одновременно вызывает рост напряжения и, следовательно, удельного расхода энергии.
В небольшом разделе, посвященном принципам электролиза, естественно, невозможно полностью осветить вопросы, связанные с эффективностью процесса. Если мерилом его эффективности принять расходные коэффициенты (энергии углерода, фторидов) в расчете на тонну алюминия, количество вредных выбросов и себестоимость передела, то окажется, что перечисленные величины зависят приблизительно от 100 характеристик исходных продуктов и 30 технологических параметров, зачастую тесно связанных друг с другом. Эту связь позволяют выявить статистические методы анализа, современные компьютерные методы нейронного анализа, аналитические зависимости и т.п. силлиманит (А12О3-SiO2), муллит (ЗА12О3 • 2SiO2) и др. В этом случае восстановлению подвергается также оксид кремния. При таком процессе получаются сплавы, содержащие, как правило, не более 60 % алюминия. Богатые по кремнию сплавы могут быть расшихтованы алюминием до силуминов, используемых в промышленности, которые содержат около 10 % кремния.
Алюминий может быть выделен из сплава растворением (экстракцией) такими металлами, как магний, ртуть, свинец, цинк при высоких температурах с последующей отгонкой металлов, имеющих высокую упругость пара.
Интересным методом выделения алюминия из сплавов является субгалогенидная дистилляция. Реакция взаимодействия алюминия с его фторидом
1200 °С 800 "С
2А1 (в сплаве) + A1F3 = 3A1F (пар) = 2А1 (жидкость) + A1F3 (15)
приводит при 1200 °С к образованию пара субфторида, который при 800 °С разлагается (диспропорционирует) на металл и трехвалентную соль. Сходные реакции, но при меньших температурах протекают при воздействии на алюминий его трихлорида.
Описанные (и многие другие) процессы термического восстановления и последующего рафинирования при всей их привлекательности пока не стали промышленными, не выдержав экономической конкуренции.


