МЕТАЛЛЫ И СПЛАВЫ
Классификация и свойства металлов и сплавов
К металлам относятся вещества, обладающие высокими теплопроводностью и электрической проводимостью, ковкостью, блеском и другими характерными свойствами, которые обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Единственными объективными критериями, позволяющими отнести материал к металлам, считаются наличие электропроводности при Т = 0 К и положительный температурный коэффициент удельного сопротивления. Указанными выше свойствами обладают свыше 80 простых веществ (элементов) и множество металлических сплавов.
Все металлы и сплавы делят на черные (к ним относят железо и сплавы на его основе; на их долю приходится около 95 % производимой в мире металлопродукции) и цветные или, точнее, нежелезные (все остальные металлы и сплавы). По физическим и химическим свойствам и характеру залегания в земной коре нежелезные металлы делят на следующие группы: легкие – алюминий, магний, титан, бериллий, литий, натрий, калий, стронций, барий и др.; тяжелые – медь, никель, кобальт, свинец, олово, цинк, кадмий, сурьма, висмут, ртуть и др.; тугоплавкие – вольфрам, молибден, ниобий, тантал, ванадий, хром, цирконий и др.; благородные – золото, серебро, платина и платиноиды (рутений, родий, палладий, осмий, иридий); рассеянные – галлий, индий, таллий; редкоземельные – скандий, иттрий, лантан и все лантаноиды; радиоактивные – технеций, франций, радий, полоний, актиний, торий, уран и трансурановые элементы.
Приведенная классификация условна: многие металлы могут быть отнесены одновременно к разным группам. Например, легкий металл титан является также тугоплавким; тугоплавкий металл рений – типичный рассеянный элемент и т.д.
Металлы играют огромную роль в современной технике. Обычно металлы применяют не в чистом виде, а в виде сплавов, количество которых превышает 10 тысяч.
Металлы получают из руд, а также путем вторичной переработки материалов. Рудами называют горные породы, которые технически возможно и экономически целесообразно перерабатывать для извлечения содержащихся в них металлов. К основным процессам металлургического процесса относятся: обработка руд с целью их подготовки к извлечению металлов (дробление, обогащение, окускование и пр.); извлечение металлов из руд и других материалов; очистка металлов от нежелательных примесей; производство металлов и сплавов; термическая, химико-термическая и термомеханическая обработка; формообразование давлением и литьем; покрытие в декоративных или защитных целях поверхности изделий из металла слоями другого металла.
К основным свойствам металлов и сплавов относятся физические (в том числе механические), химические, технологические и функциональные. К физическим свойствам относятся: температура плавления, цвет, плотность, магнитная восприимчивость, электропроводность, теплоемкость и др. Особую группу составляют механические свойства: прочность, пластичность, твердость, ударная вязкость и др.
Химические свойства металлов определяются способностью их атомов легко отдавать валентные электроны и переходить в состояние положительно заряженных ионов. Указанное определяет особенности химического взаимодействия металлов и сплавов с агрессивными средами.
К технологическим свойствам металлов и сплавов относится их способность к формоизменению (ковкость, свариваемость и т.д.). Важное значение имеет жидкотекучесть – свойство расплавленного металла заполнять и точно воспроизводить литейную форму.
Функциональные или эксплуатационные свойства включают в себя хладостойкость, жаропрочность, жаростойкость, антифрикционность и другие характеристики материалов, определяемые условиями их работы.
Строение и кристаллизация металлов
Металлы и сплавы в твердом состоянии имеют поликристаллическую структуру, состоящую из отдельных зерен – монокристаллических областей, ориентированных относительно друг друга под различными углами. На границе между зернами атомы имеют менее правильное расположение, чем в объеме зерна. Линейный размер зерен составляет 1–104 мкм.
С помощью рентгеноструктурного анализа установлено, что кристаллическое строение твердых тел, состоящих из различных атомов, описывается 14 различными типами пространственных элементарных ячеек.
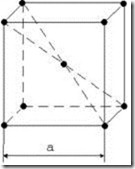
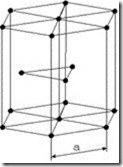
Наиболее широко применяются металлы и сплавы, образованные одним из 3-х типов пространственных решеток, определяемых отдельно взятой элементарной ячейкой: кубической объемно центрированной ОЦК (a–Fe, b–Fe, d–Fe, Cr, W, Mo, V и др.); кубической гранецентрированной ГЦК (g–Fe, Cu, Al, Ni, Pb и др.); гексагональной плотноупакованной ГПУ (Ti, Mg, Zn, Be и др.) (рис. 3.1).
Переход металла из жидкого состояния в твердое (кристаллическое) называется кристаллизацией. Подвижность атомов при снижении температуры уменьшается, устанавливается определенный порядок в их расположении с образованием отдельных групп атомов, близких к элементарным ячейкам, имеющимся в твердом металле. Возникают центры кристаллизации – зародыши, вокруг которых постепенно образуется твердая фаза. Кристаллизация происходит вследствие перехода к более устойчивому состоянию с меньшей свободной энергией [7].
|
a б в |
Рис. 3.1. Атомно-кристаллическое строение металлов с кубической объемно центрированной (а); гранецентрированной (б) и гексагональной плотноупакованной (в) элементарными ячейками
Процесс кристаллизации характеризуют кривыми охлаждения или нагревания, изображенными в координатах температура – время. На рис. 3.2 изображены кривые охлаждения металла и двухкомпонентного сплава. При охлаждении расплавленного чистого металла вначале (участок 1 – 2 рис. 3.2,а) понижение температуры идет плавно. При достижении температуры кристаллизации на кривой охлаждения (рис. 3.2,а) появляется горизонтальный участок 2 – 3, так как отвод тепла в окружающую среду компенсируется выделяющейся скрытой теплотой кристаллизации. После окончания кристаллизации температура вновь понижается равномерно (участок 3 – 4 рис. 3.2, а).
При охлаждении из жидкого состояния сплава двух металлов процесс кристаллизации протекает несколько иначе (рис. 3.2, б).
Точка 2 соответствует началу выделения из жидкой фазы кристаллов одного из компонентов сплава. Выделяющаяся при кристаллизации теплота замедляет ход кривой охлаждения, и в точке 2 кривая изменяет наклон (участок 2 – 3). Выпадение кристаллов избыточного компонента и равномерное понижение температуры происходят, пока сплав не достигнет определенного состава. В дальнейшем наблюдается одновременная кристаллизация компонентов, происходящая при постоянной температуре (участок 3 – 4 рис. 3.2,б). После полного затвердевания сплава в точке 4 его температура снова начинает снижаться по плавной кривой 4 – 5.
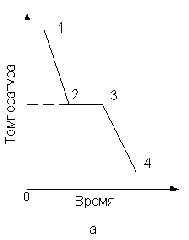
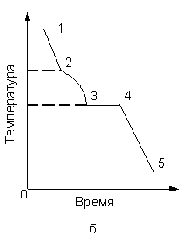
Рис. 3.2. Кривые охлаждения металла (а) и двухкомпонентного сплава (б)
Температура, соответствующая каким-либо фазовым превращениям в металле или сплаве, называется критической точкой. При нагревании твердых металлов или сплавов процесс их расплавления сопровождается поглощением теплоты.
Основные типы сплавов
Чистые металлы в большинстве случаев не обеспечивают необходимого комплекса механических, технологических и функциональных свойств и поэтому применяются редко. В большинстве случаев в технике используют сплавы.
Металлическим сплавом называют материал, состоящий из двух или более компонентов и обладающий свойствами, характерными для металлов. Сплавы создаются в результате расплавления, спекания исходных компонентов и другими методами [7]. Необходимым процессом получения сплава является диффузия элементов в твердом, жидком или газообразном состоянии. Диффузия осуществляется путем взаимного проникновения частиц каждого из компонентов сплава с образованием новых однородных тел, называемых фазами.
Для описания свойств сплавов в металловедении используют понятия: система, фаза, компонент.
Системой называют совокупность фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении).
Фазой называют однородную по химическому составу, кристаллическому строению и свойствам часть системы, отделенную от ее других частей поверхностью раздела. Однофазной системой являются, например, однородная жидкость, твердый чистый металл; двухфазной – механическая смесь двух видов кристаллических веществ.
Компонентами называют вещества, образующие систему. Компонентами могут быть элементы (металлы и неметаллы), а также химические соединения. По числу компонентов различают двойные, тройные и многокомпонентные сплавы. Компонент сплавов может быть основным, легирующим или случайным.
Сплавы, находящиеся в твердом состоянии, делят по составу на 3 группы: твердый раствор, химическое соединение, механическая смесь компонентов.
Твердый раствор. В жидком состоянии большинство металлических сплавов представляет собой однородные жидкости, т.е. жидкие растворы. При переходе в твердое состояние во многих таких сплавах однородность, а следовательно и растворимость, сохраняется. Твердый раствор, как и металл, имеет одну кристаллическую решетку, соответствующую типу кристаллической решетки основного компонента сплава (растворителя). Различие состоит в том, что в кристаллической решетке металла размещаются атомы одного элемента, а в твердом растворе – атомы различных элементов, образующих этот твердый раствор.
По характеру размещения атомов в кристаллической решетке различают твердые растворы замещения (рис. 3.3,а) и твердые растворы внедрения (рис. 3.3,б).
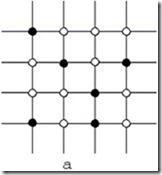
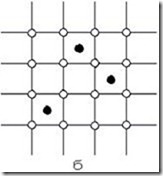
Рис. 3.3. Расположение атомов в твердых растворах [1]: а – замещения; б – внедрения; ™ – атом компонента-растворителя; ˜ – атом растворимого компонента
В твердых растворах замещения, состоящих из компонентов А и В, атомы растворимого компонента В замещают отдельные атомы основного компонента А – растворителя в кристаллической решетке. В этом случае при несовпадении размеров атомов размер элементарной ячейки может изменяться. Растворимость в твердом состоянии может быть неограниченной или ограниченной. Неограниченная растворимость обеспечивает замещение в кристаллической решетке любого числа атомов компонента А атомами компонента В.
Неограниченная растворимость возможна при следующих условиях:
1) наличие у компонентов кристаллических решеток (элементарных ячеек) одного типа;
2) незначительное отличие размеров атомов компонентов (не более чем на 8 %);
3) достаточно близкое соответствие строения валентных оболочек атомов компонентов (тип химической связи).
Примерами сплавов с неограниченной растворимостью компонентов являются сплавы Cu–Ni, Fe–Ni, Fe–Cr и др.
Если компоненты сплава не полностью удовлетворяют указанным выше условиям, образуются твердые растворы замещения с ограниченной растворимостью компонентов.
При этом чем больше разница в размерах атомов компонентов, тем меньше растворимость в твердом состоянии. С изменением температуры ограниченная растворимость в твердом состоянии обычно меняется. Примерами систем с ограниченной растворимостью компонентов являются Al–Cu, Mg–Al и др.
В твердом растворе внедрения атомы растворимого компонента внедряются в междоузлия кристаллической решетки основного компонента (рис. 3.3,б). Такие твердые растворы обычно образуются, когда атомы растворимого компонента имеют небольшие размеры по сравнению с атомами растворителя. Чаще всего это имеет место, когда в металле растворяются неметаллические элементы. Примером твердого раствора внедрения является сплав Fe–C.
Химическое соединение. Элементы, образующие химические соединения, обычно резко отличаются по размерам атомов, строению электронных оболочек и параметрам кристаллических решеток. К образованию химических соединений склонны элементы, далеко расположенные друг от друга в периодической таблице Д.И. Менделеева.
В отличие от обычных химических соединений многие металлические соединения имеют переменный состав, который может изменяться в широких пределах. Получение химического соединения AmBn с образованием однородного кристаллического вещества возможно только при строго определенных весовых соотношениях компонентов. При этом образуется кристаллическая решетка, не похожая на решетки сплавляемых компонентов. Примером может служить сплав Cu–Mg при содержании 17 % Mg. Свойства сплава – химического соединения резко отличаются от свойств элементов, образующих его.
Сплавы – химические соединения не всегда встречаются в чистом виде. Например, при избытке растворимого компонента возможно образование химического соединения в комбинации с твердым раствором.
Механическая смесь. Образование механических смесей происходит, когда элементы обладают ограниченной растворимостью, а также при наличии химического соединения. Механические смеси могут состоять из кристаллов чистых компонентов, твердых растворов и химических соединений. При образовании механической смеси кристаллические решетки отдельных фаз не меняются. Механические смеси обычно образуют металлы, отличающиеся друг от друга размерами атомов и температурой плавления. Примером сплава, образующего механическую смесь, является система Ag–Pb.
Приведенные выше положения указывают в общем виде на особенности взаимодействия элементов при образовании сплавов и на их возможную структуру. Однако при образовании и термообработке сплавов на основе конкретных компонентов возникают особенности, которые в металловедении изучаются экспериментально. Например, для установления режимов термической обработки сплавов с целью придания им необходимых свойств необходимо знать температуры начала и окончания процессов плавления, перехода в твердое состояние, особенности структурных превращений в критических точках. Построение кривых охлаждения (нагревания) на основе экспериментальных данных называется термическим анализом. Полученные экспериментальные данные систематизируют, обобщают и отображают в виде особых диаграмм – диаграмм состояния сплавов.
ДИАГРАММЫ СОСТОЯНИЯ ДВУХКОМПОНЕНТНЫХ СПЛАВОВ
Диаграмма состояния представляет собой графическое изображение фазового состояния сплавов и критических точек в зависимости от температуры и концентрации в условиях равновесия.
Для того чтобы обеспечить равновесное состояние системы, охлаждение сплава из жидкого состояния осуществляют очень медленно. Равновесными считаются такие условия, при которых процессы, протекающие в системе, являются обратимыми. В данном случае – процессы, происходящие при охлаждении сплава, должны в точности совпадать с процессами, протекающими при его нагреве.
Диаграмму состояния строят в координатах температура – концентрация (рис. 3.4). Для сплавов, состоящих из двух компонентов А и В, состав характеризуется отрезком прямой, принятым за 100 %. Крайние точки А и В соответствуют 100 % чистых компонентов. Любая точка на этом отрезке характеризует состав двойного сплава. Так, например, точка С соответствует сплаву, состоящему из 20 % В и 80 % А; точка D – 60 % В и 40 % А.
Для построения диаграммы состояния из компонентов изготовляют серию сплавов различного состава и для каждого из них строят кривую охлаждения по результатам термического анализа в координатах температура – время (так же, как для металлов). Особенности поликристаллического строения сплавов в твердом состоянии изучаются с помощью оптического микроскопа обычно при 100–1000-кратном увеличении. Атомная структура сплавов и параметры кристаллических решеток определяются методом рентгеноструктурного анализа.
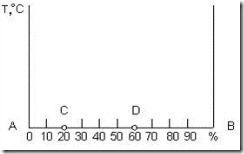
Рис. 3.4. Координаты для изображения диаграммы состояния двухкомпонентной системы
В зависимости от характера строения двухкомпонентных сплавов (в жидком состоянии оба компонента неограниченно растворяются друг в друге, образуя однородный жидкий раствор) различают следующие основные типы диаграмм состояния:
1) при образовании компонентами механической смеси;
2) при неограниченной растворимости компонентов в твердом состоянии;
3) при ограниченной растворимости компонентов в твердом состоянии;
4) при образовании компонентами химического соединения.
Диаграмма состояния сплавов из компонентов,
образующих в твердом состоянии механическую смесь
Экспериментально установлено, что при совместной кристаллизации сплавов, компоненты которых не растворяются друг в друге в твердом состоянии, температура начала кристаллизации всегда ниже, чем у исходных компонентов. Температура же окончания процесса перехода в твердое состояние одинакова для сплавов любого состава двухкомпонентной системы.
На рис. 3.5 приведена диаграмма состояния сплава с компонентами А и В. Выше линии КСN все сплавы двухкомпонентной системы представляют собой однофазный жидкий сплав (ж. с.). Эта линия называется линией ликвидуса (с греч. – жидкий), линия DСЕ – линией солидуса (с греч. – твердый). Ниже линии DСЕ все сплавы находятся в твердом состоянии. Сплав, соответствующий точке С, называется эвтектическим (эвтектикой).
Эвтектикой, таким образом, называется механическая смесь кристаллов двух (или более) твердых веществ, одновременно закристаллизовавшихся из жидкого сплава при температуре ниже температуры плавления отдельных компонентов или любых других их смесей. Это определение относится к твердой эвтектике. Жидкой эвтектикой называется жидкий расплав (раствор), из которого возможна такая кристаллизация.
В отличие от эвтектики, эвтектоид – аналогичная ей составляющая металлических сплавов, – образуется не из жидкой, а из твердой фазы. Эвтектоид, по сравнению с эвтектикой, имеет более тонкое дисперсное строение из двух или более фаз.
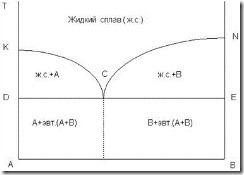
Рис. 3.5. Диаграмма состояния сплавов, образующих в твердом состоянии механическую смесь компонентов А и В
Эвтектический сплав данной системы имеет строго определенное процентное соотношение компонентов А и В. Сплавы, расположенные слева от эвтектики, называются доэвтектическими, а справа – заэвтектическими.
В доэвтектических сплавах сначала при охлаждении ниже линии ликвидуса КС выделяются кристаллы компонента А, а в заэвтектических – ниже линии СN – кристаллы компонента В.
После затвердевания, т.е. ниже линии солидуса DСЕ, доэвтектические сплавы состоят из кристаллов А и эвтектики, а заэвтектические – из кристаллов В и эвтектики.
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии
Рассмотрим построение диаграммы состояния для сплавов с неограниченной растворимостью в твердом состоянии. Например, экспериментально получены кривые охлаждения компонентов А и В и сплавов I (70 % А и 30 % В), II (50 % А и 50 % В) и III (20 % А и 80 % В) (рис. 3.6, а).Кристаллизация компонента А начинается и заканчивается при постоянной температуре tA. Аналогично происходит кристаллизация компонента В при температуре tB. Кристаллизация сплавов I, II и III происходит в интервале температур. Кристаллизация сплава I начинается при температуре t1 и заканчивается при температуре t2 с образованием твердого раствора a. Аналогично происходит кристаллизация и двух других сплавов – при температуре t3 начинается и при температуре t4 заканчивается затвердевание сплава II, а сплава III – при температурах t5 и t6. Разница только в интервале температур начала и конца кристаллизации.
Если на оси абсцисс сетки в координатах температура – концентрация (рис. 3.6, б) отметить точками исследованные сплавы и в каждой из этих точек восстановить перпендикуляры, т.е. провести линии сплавов, затем на эти линии, а также на левую и правую ординаты температур, соответствующие компонентам А (левая) и В (правая), перенести найденные критические точки от tA до tB и одноименные (имеющие одинаковый физический смысл) критические точки соединить плавными кривыми, то получится диаграмма состояния сплавов А и В с неограниченной растворимостью в твердом состоянии (рис. 3.6, б).
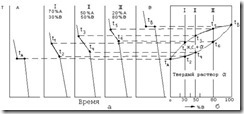
Рис. 3.6. Построение диаграммы состояния сплавов для случая неограниченной растворимости компонентов А и В в твердом состоянии [7]:
а – кривые охлаждения; б – диаграмма состояния
На этой диаграмме кривая tAt1t3t5tB – кривая начала затвердевания сплавов – линия ликвидуса, а кривая tAt2t4t6tB – кривая конца затвердевания – линия солидуса.
Рассмотрим процесс кристаллизации какого-либо сплава, например сплава I состава 50 % компонента А и 50 % компонента В по этой диаграмме при очень медленном охлаждении, т.е. полностью в равновесных условиях (рис. 3.7). При температуре tл начинается кристаллизация и образуются первые кристаллы. На любой диаграмме состояния состав твердой части сплава (состав кристаллов, которые могут находиться в равновесии с жидкостью) при данной температуре показывает линия солидуса. Следовательно, первые образовавшиеся кристаллы имеют состав точки М. При дальнейшем охлаждении, когда сплав достигает, например, температуры t1, в равновесии с жидкостью уже находятся только кристаллы состава точки Л.
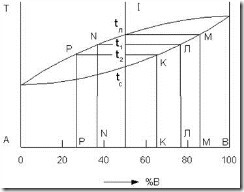
Рис. 3.7. Диаграмма состояния сплавов для случая неограниченной растворимости компонентов А и В в твердом состоянии
Рассмотрим, каким образом ранее образовавшиеся кристаллы состава точки М превращаются в кристаллы состава точки Л. В кристаллах состава М больше компонента В, чем в кристаллах состава Л; следовательно, кристаллы состава М обогащаются компонентом А. Этот процесс происходит за счет диффузии атомов компонента А в уже имеющиеся, т.е. возникшие до этой температуры, кристаллы. При достаточной выдержке или медленном охлаждении при t1 устанавливается равновесие кристаллов точки Л и жидкого сплава. Но в кристаллах состава точки Л компонента В больше, чем в сплаве; следовательно, жидкая часть сплава беднее компонентом В. При этой температуре состав жидкой части сплава определяется линией ликвидуса, т.е. точкой N. При дальнейшем охлаждении, когда сплав достигает температуры t2 и устанавливается равновесие, сплав состоит из кристаллов состава точки К и жидкой части сплава состава точки Р. При достижении температуры tc сплав полностью затвердевает и состоит из однородных кристаллов твердого раствора (состава 50 % А и 50 % В).
В реальных условиях ускоренного охлаждения состав кристаллов не получается однородным в связи с тем, что скорость кристаллизации больше скорости диффузии.
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
Один из видов такой диаграммы состояния показан на рис. 3.8. Число фаз в данной системе три – жидкий раствор, твердый раствор компонента В в компоненте А (обозначим его a) и твердый раствор компонента А в компоненте В (обозначим его b) [7].
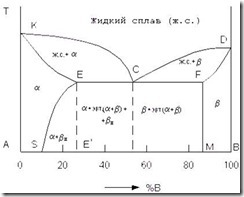
Рис. 3.8. Диаграмма состояния сплавов для случая ограниченной
растворимости компонентов А и В в твердом состоянии
На этой диаграмме линия КСD – линия ликвидуса, линия KECFD – линия солидуса. По линии ликвидуса КС из жидкого сплава выделяются кристаллы a, а по линии CD – кристаллы b. На линии солидуса КЕ сплавы затвердевают с образованием кристаллов a, на линии DF – кристаллов b. На линии солидуса ECF происходит одновременная кристаллизация a- и b-фаз с образованием эвтектики.
Сплав состава точки С после затвердевания состоит только из одной эвтектики a+b. Аналогично ранее рассмотренному случаю сплавы, по своему составу находящиеся левее эвтектической точки С (на линии ЕС), после затвердевания имеют структуру a+эвтектика (a+b) и являются доэвтектическими. Сплавы, по своему составу лежащие правее точки С (на линии СF), после затвердевания имеют структуру b+эвтектика (a+b) и являются заэвтектическими.
Линия ЕS показывает ограниченную растворимость в твердом состоянии компонента В в компоненте А, уменьшающуюся с понижением температуры, а линия FM – растворимость компонента А в В, не изменяющуюся с понижением температуры.
Точка Е характеризует предельную растворимость компонента В в компоненте А, а точка F – A в В. Если кристаллизуются сплавы, состав которых находится левее точки S (или правее точки М), то при любой температуре в твердом состоянии все количество компонентов В (или А) находится в твердом растворе и структура таких сплавов состоит из зерен a (или b). В сплавах, состав которых находится между точками S и Е', т.е. за пределом растворимости В в А, образовавшиеся при затвердевании кристаллы a при понижении температуры ниже линии ES пересыщены компонентом В, и поэтому происходит выделение из них избыточных кристаллов, которыми являются кристаллы b концентрации точки М, называемые вторичными (b11). После полного охлаждения эти сплавы имеют структуру, состоящую из кристаллов a состава точки S и кристаллов b11 – a + b11. В сплавах состава линии EC, имеющих после затвердевания структуру a + эвтектика (a+b), из кристаллов a тоже выделяются кристаллы b, и после полного охлаждения будет структура a + эвтектика (a+b)+b11.
Процесс выделения вторичных кристаллов из твердого раствора называется вторичной кристаллизацией, в отличие от образования кристаллов в жидком сплаве (первичная кристаллизация).
Диаграмма состояния сплавов с образованием компонентами химического соединения
Химическое соединение обозначают АmBn. Это означает, что в данном соединении на m атомов компонента А приходится n атомов компонента В. Диаграмма состояния сплавов для случая образования между компонентами химического соединения, состав которого при нагреве и охлаждении не изменяется, приведена на рис. 3.9.
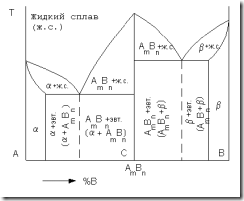
Рис. 3.9. Диаграмма состояния сплавов для случая образования компонентами А и В химического соединения
Данная диаграмма как бы составлена из двух диаграмм: компонент А – химическое соединение AmBn и компонент В – химическое соединение AmBn. В сплавах левее точки С (соответствующей по составу химическому соединению AmBn) компонента А имеется больше, чем входит в химическое соединение. Следовательно, в этих сплавах левее точки С образуется эвтектика a+ AmBn. В сплавах правее точки С компонента В больше, чем может входить в химическое соединение. Следовательно, в этих сплавах образуется эвтектика AmBn+b.
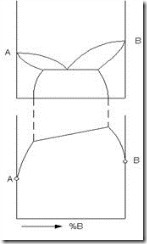
Связь между свойствами сплавов и типом диаграммы состояния
Основоположником учения о связи диаграмм состояния со свойствами сплавов является академик Н.С. Курнаков.

а б

в г
|
Рис. 3.10. Свойства сплавов и вид их диаграммы состояния |
ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ ЖЕЛЕЗО – УГЛЕРОД
Основные свойства железа
Чистое железо – металл серебристо-белого цвета, весьма пластичный. Железо образует несколько окислов: FeO, Fe2O3, Fe3O4. Температура плавления Тпл=1539 °С, кипения – Ткип=2450 °С. Свойства железа в значительной степени зависят от содержания углерода, в меньшей – от других компонентов, концентрация которых ниже (Si, Mn, P, S и др.).
Для железа характерно явление полиморфизма (аллотропии), при котором твердые вещества могут изменять тип кристаллической решетки и свойства под воздействием внешних факторов (температура, давление и т.д.) Железо имеет 4 полиморфные модификации: a-, b-, g- и d-Fe. Кристаллическая решетка a-, b- и d-Fe – ОЦК с разными межатомными расстояниями, g-Fe – ГЦК. Модификации a- и g-Fe способны образовывать твердые растворы с углеродом. Другими примерами веществ, обладающих аллотропными модификациями структуры и свойств, являются: углерод (алмаз и графит); двуокись кремния (a- и b-кварц, тридимит, кристобалит, стишовит, коэсит); серое и белое олово.
Полиморфные превращения являются обратимыми, в процессе выделяется скрытая теплота кристаллизации (если превращение идет при охлаждении). На кривой охлаждения появляются критические точки и горизонтальные участки, соответствующие процессам перекристаллизации.
На рис. 3.11 приведена кривая охлаждения железа из расплавленного состояния, на которой горизонтальными участками отделены температурные интервалы существования различных модификаций железа.

Рис. 3.11. Кривая охлаждения железа
При переходе b-Fe в a-Fe тип кристаллической решетки сохраняется, но меняются физические свойства: железо из парамагнитного состояния переходит в ферромагнитное, т.е. при температуре ниже 768 °С становятся возможными спонтанная намагниченность материала и его доменная структура.
К железоуглеродистым сплавам относят стали и чугуны. Основными элементами, от которых зависят структура и свойства сталей и чугунов, являются железо и углерод.
Железо с углеродом образует твердые растворы внедрения и химическое соединение; a–железо растворяет очень мало углерода (до 0,02 % при 727 °С). Твердый раствор углерода и других элементов в a-железе называется ферритом. Феррит имеет низкую твердость и прочность: НВ 80; sB=250 МПа (25 кгс/мм2) и высокую пластичность (Q=50 %). g-железо растворяет значительно большее количество углерода – до 2,14 % при 1147 °С. Твердый раствор углерода и других элементов в g-железе называется аустенитом. В железоуглеродистых сплавах он может существовать только при высоких температурах. Аустенит пластичен, твердость его НВ 160–200, Q=40¸50 %.
Железо с углеродом также образует химическое соединение Fe3C, называемое цементитом или карбидом железа. В цементите содержится 6,67 % С; он имеет высокую твердость (~НВ 800), но чрезвычайно низкую, практически нулевую пластичность.
Диаграмма состояния железо – цементит(Fe – Fe3C)
Диаграмма состояния Fe – Fe3C (в упрощенном виде) приведена на рис. 3.12. На этой диаграмме точка А (1539 °С) соответствует температуре плавления (затвердевания) железа, а точка D (~1600 °С) – температуре плавления (затвердевания) цементита. Линия ACD – линия ликвидуса, показывающая температуры начала затвердевания (конца плавления) сталей и чугунов. Линия AECF – линия солидуса, показывающая температуры конца затвердевания (начала плавления).

Рис. 3.12. Диаграмма состояния Fe – Fe3C (в упрощенном виде)
По линии ликвидуса АС (при температурах, соответствующих линии АС) из жидкого сплава кристаллизуется аустенит, а по линии ликвидуса CD – цементит, называемый первичным цементитом.
В точке С при 1147 °С и содержании 4,3 % С из жидкого сплава одновременно кристаллизуются аустенит и цементит первичный, образуя эвтектику, называемую ледебуритом. По линии солидуса АЕ сплавы с содержанием до 2,14 % С окончательно затвердевают с образованием аустенита. По линии солидуса ЕС (1147 °С) сплавы с содержанием 2,14–4,3 % С окончательно затвердевают с образованием эвтектики ледебурита. Так как при более высоких температурах из жидкого сплава выделяется аустенит, следовательно, такие сплавы после затвердевания имеют структуру аустенит+ледебурит. По линии солидуса CF (1147 °С) сплавы с содержанием 4,3–6,67 % С окончательно затвердевают также с образованием эвтектики ледебурита. Так как при более высоких температурах из жидкого сплава выделяется цементит (первичный), следовательно, такие сплавы после затвердевания имеют структуру – первичный цементит+ледебурит.
В результате первичной кристаллизации во всех сплавах с содержанием до 2,14 % С образуется однофазная структура – аустенит. Сплавы железа с углеродом, в которых в результате первичной кристаллизации в равновесных условиях получается аустенитная структура, называют сталями. Следовательно, сталь – это железоуглеродистые сплавы с содержанием до 2,14 % С. Сплавы с содержанием более 2,14 % С, в которых при кристаллизации образуется ледебурит, называют чугунами. Следовательно, чугун – это железоуглеродистые сплавы с содержанием более 2,14 % С. Излом таких чугунов светлый, блестящий (белый излом), поэтому такие чугуны называют белыми.
В железоуглеродистых сплавах превращения в твердом состоянии характеризуют линии GSE, PSK, PQ. Линия GS показывает начало превращения аустенита в феррит (при охлаждении). Критические точки, лежащие на линии GS, обозначают А3 (при нагреве Аc3, а при охлаждении Аr3). Линия SE показывает, что с понижением температуры растворимость углерода в аустените уменьшается. Так, при 1147 °С в аустените может раствориться 2,14 % С, а при 727 °С – 0,8 % С. С понижением температуры из аустенита выделяется избыточный углерод в виде цементита, называемого вторичным. Критические точки, лежащие на линии SE, обозначают Аст. В чугунах с содержанием 2,14–4,3 % С при 1147 °С, кроме ледебурита, есть аустенит, из которого при понижении температуры тоже выделяется вторичный цементит.
Линия PSK (727 °С) – линия эвтектоидного превращения. На этой линии во всех железоуглеродистых сплавах аустенит распадается, образуя структуру, представляющую собой механическую смесь феррита и цементита и называемую перлитом (~НВ 200). Критические точки, лежащие на линии PSK, обозначают А1 (при нагреве Ас1, а при охлаждении Ar1).
Линия PQ показывает, что с понижением температуры растворимость углерода в феррите уменьшается от 0,02 % при 727 °С до 0,006 % при комнатной температуре. При охлаждении ниже 727 °С из феррита выделяется избыточный углерод в виде цементита, называемого третичным.
Ниже 727 °С железоуглеродистые сплавы имеют следующие структуры.
Стали, содержащие менее 0,8 % С – феррит+перлит, называют доэвтектоидными сталями (рис. 3.13, а).
Стали с содержанием 0,8 % С – перлит, называют эвтектоидными сталями (рис. 3.13, б).
Стали с содержанием 0,8–2,14 % С – перлит и цементит (вторичный), называют заэвтектоидными сталями (рис. 3.13, в).
В рассмотренных выше сплавах, таким образом, имеются 3 твердые фазы – феррит, цементит и аустенит и эти же фазы в структурно связанном состоянии: эвтектоид – перлит и эвтектика – ледебурит.
В сплавах железо – углерод при распаде аустенита взможна кристаллизация углерода в свободном состоянии в виде графита.

Рис. 3.13. Микроструктура стали [7]: а – доэвтектоидная сталь – феррит (светлые участки) и перлит (темные участки), ´500; б – эвтектоидная сталь – перлит, ´ 1000; в – заэвтектоидная сталь – перлит и цементит (в виде сетки), ´ 200
Графит является неметаллической фазой, он мягок и обладает низкой пластичностью, располагается в основной массе сплава, имеет развитую объемную форму в виде пластинок.
Диаграмма состояния системы железо – цементит используется на практике для определения видов и режимов термической обработки стали с целью придания сплаву необходимых свойств.
Термическая и химико-термическая обработка стали
Термической обработкой называют процессы, связанные с нагревом и охлаждением, вызывающие изменения внутреннего строения сплава и обусловленные этим изменения физических, механических и других свойств.
Основой процессов термической обработки является полиморфизм железа и его твердых растворов на основе a- и g-Fe. В результате полиморфизма происходит изменение кристаллической структуры сплавов в твердом состоянии. Следует отметить, что нагрев или охлаждение однокомпонентного металла (железа) не оказывает значительного влияния на его структуру и свойства. Между тем термическая обработка углеродистой стали при определенных условиях позволяет изменять структуру материала и его физико-механические свойства в широких пределах.
Термической обработке с целью требуемого изменения структуры и свойств (твердости, обрабатываемости и др.) подвергают как полуфабрикаты (заготовки), так и готовые изделия (детали, инструмент). В зависимости от структурного состояния стали, получаемого в результате применения термообработки, последняя подразделяется на отжиг (первого и второго рода), нормализацию, закалку и отпуск.
Технологический процесс термообработки включает 3 последовательно выполняемые операции:
1) нагрев до определенной температуры;
2) выдержку при этой температуре;
3) охлаждение с заданной скоростью.
Для понимания особенностей фазовых превращений, происходящих при термической обработке стали, необходимо рассмотреть процесс перехода аустенита в перлит. Этот процесс включает 4 этапа.
1. При охлаждении аустенита до температуры, равной 727 °С, происходит практически мгновенный переход g-Fe в a-Fe с изменением типа кристаллической решетки с ГЦК на ОЦК. При этом выделяется избыточный углерод, который не успевает диффундировать и остается в решетке железа. В результате образуется сплав – пересыщенный твердый раствор углерода в a-Fe, который носит название мартенсит (твердость – 62 – 65 НВ).
2. Углерод начинает диффундировать к центрам кристаллизации, и образуется смесь кристаллов a-Fe+C и цементита Fe3C. Линейный размер кристаллов цементита составляет ~10-5мм. Такой сплав называется трооститом (твердость – 40 НВ).
3. Зерна Fe3C увеличиваются до ~10-4мм, и образуется смесь кристаллов a-Fe+C и Fe3C, которая называется сорбитом (твердость – 30 НВ).
4. Зерна Fe3C вырастают до размера, превышающего 10-3 мм, и образуется перлит (твердость – 15–20 НВ).
Структуры аустенита и перлита являются стабильными (равновесными), а мартенсита, троостита и сорбита – неравновесными.
Известно, что если аустенит охлаждать со скоростью 50 град/с, образуется сорбит; 100 град/с – троостит; 150–200 град/с – мартенсит. При термообработке, вызывающей переход аустенита в мартенсит, плотность стали уменьшается [плотность аустенита – (8,0–8,1) г/см3, мартенсита – 7,8 г/см3], а линейные размеры и объем увеличиваются. Поэтому после термообработки в материале возникают внутренние механические напряжения.
Отжигом называется процесс термической обработки, включающий нагрев до определенной температуры, выдержку и последующее, как правило медленное, охлаждение (в печи) с целью получения более равновесной структуры стали. В результате отжига устраняются внутренние напряжения, измельчается зерно, повышается пластичность стали.
Отжиг первого рода – это термическая обработка, при которой, как правило, не происходит фазовых превращений (перекристаллизации), а если они имеют место, то не оказывают влияния на конечные результаты, предусмотренные целевым назначением. В зависимости от температурного режима отжиг первого рода устраняет неоднородности химического состава или физических свойств, созданные предшествующими обработками. Разновидностями отжига первого рода являются диффузионный и рекристаллизационный.
Целью диффузионного отжига (гомогенизации) являются выравнивание химического состава и удаление дендритной структуры кристаллов в фасонных отливках и слитках легированной стали. Неоднородность химического состава заготовок повышает анизотропию их свойств и склонность стали, обрабатываемой давлением, к хрупкому разрушению. Диффузионный отжиг производится при температурах 1100 – 1200 °С в течение 30 – 50 ч. Только при таких условиях наиболее эффективно протекают диффузионные процессы, необходимые для выравнивания состава стали по всему объему. Общая продолжительность процесса, включающая нагрев, выдержку и медленное охлаждение со скоростью 30 – 100 град/ч (обычно вместе с печью), может превышать 100 ч.
Рекристаллизационный отжиг (разновидность низкого отжига) – термическая обработка холоднодеформированной стали, включающая нагрев выше температуры рекристаллизации, выдержку при этой температуре и последующее охлаждение. Целью рекристаллизационного отжига является устранение наклепа и получение определенной величины зерна. Наклеп возникает в результате весьма высоких давлений, применяемых при обработке давлением, резанием и пр. Зерна поверхностных слоев приобретают вытянутую форму. Создаются относительные смещения (сдвиги) частей кристаллической решетки.
Рекристаллизационный отжиг применяют как до, так и после холодной обработки давлением для снятия созданных наклепом внутренних напряжений в материале.
Для достижения рекристаллизации по всему объему и сокращения времени процесса температура отжига должна превышать температуру порога рекристаллизации. Для углеродистых сталей (содержащих 0,08 – 0,2 % углерода), чаще подвергаемых холодной деформации (прокатке, штамповке, волочению), температура отжига составляет 680 – 700 °С, продолжительность – от 0,5 до 1,5 ч.
После отжига зерна поверхностных слоев материала, деформированные и сплющенные после наклепа, восстанавливают нормальную форму. Сталь приобретает мелкозернистое строение, пониженную твердость, повышаются пластичность и обрабатываемость в холодном состоянии.
Целью отжига второго рода являются фазовые превращения – перекристаллизация стали с достижением практически равновесного структурного (фазового) состояния. Различают следующие разновидности отжига второго рода: полный, неполный, изотермический.
Полному отжигу подвергают доэвтектоидную сталь с целью создания мелкозернистости, понижения твердости и повышения пластичности, снятия внутренних напряжений. Сталь нагревают до температуры на 30 – 50 °С выше точки Ас3. При нагреве исходная крупнозернистая ферритно-перлитная структура превращается в мелкозернистую структуру аустенита, обеспечивающую высокие вязкость и пластичность стали. Продолжительность выдержки должна быть достаточной для полного прогрева всего объема материала и завершения фазовых превращений. Чрезмерное повышение температуры выше точки Ас3 вызывает рост зерна аустенита, что ухудшает свойства стали.
При последующем медленном охлаждении из мелкозернистого аустенита образуется мелкая ферритно-перлитная структура. Медленное охлаждение должно обеспечить распад аустенита при малых степенях переохлаждения, чтобы избежать образования излишне дисперсной ферритно-карбидной структуры и свойственной ей высокой твердости.
Скорость охлаждения, необходимая для полного отжига, зависит от устойчивости переохлажденного аустенита, следовательно, от состава стали. В связи с этим легированные стали, отличающиеся высокой устойчивостью переохлажденного аустенита, охлаждаются значительно медленнее (10 –100 °С/ч), чем углеродистые (200 – 250 °С/ч).
Заэвтектоидную сталь полному отжигу не подвергают.
Неполному отжигу подвергают заэвтектоидную и эвтектоидную сталь с целью превращения пластинчатого перлита в зернистый. Для получения зернистого перлита заэвтектоидную сталь нагревают до температуры немного выше точки Ас1 (до 740 – 780 °С). При нагреве происходит превращение перлита в аустенит, а цементит остается и образуется структура цементит+аустенит.
При последующем медленном охлаждении из аустенита образуется ферритоцементитная структура с зернистой формой цементита – зернистый перлит. Заэвтектоидные (инструментальные) стали подвергают только неполному отжигу для снижения твердости и улучшения обрабатываемости резанием, а также подготовки структуры к закалке.
Доэвтектоидные стали неполному отжигу подвергают редко в связи с неполной перекристаллизацией структуры.
Изотермический отжиг обычно применяют для легированных сталей с целью полного распада аустенита и образования ферритно-перлитной структуры. Нагрев осуществляется при температуре, применяемой для полного отжига. Затем производят сравнительно быстрое охлаждение (переносом в другую печь) до температуры, лежащей ниже точки Ас1 (~650 °С), и начинают изотермическую выдержку, необходимую для полного распада аустенита, после чего следует охлаждение на воздухе.
Преимущество изотермического отжига состоит в снижении продолжительности процесса по сравнению с полным отжигом. При выборе температуры выдержки изотермического отжига, близкой к температуре минимальной устойчивости переохлажденного аустенита в перлитной области, достигается минимальное время процесса. Другим преимуществом отжига является получение более однородной структуры материала.
Изотермический отжиг улучшает обрабатываемость стали резанием и чистоту поверхности, уменьшает склонность к деформации при последующих термической и (или) химико-термической обработках.
Нормализация – это термическая обработка, включающая нагрев до температуры на 30 – 50 градусов выше критических точек Ас3 для доэвтектоидной стали и Аст для эвтектоидной стали, выдержку при этой температуре и охлаждение на воздухе.
Вследствие более быстрого охлаждения, чем при полном отжиге, структура перлита после нормализации является такой же, как после полного отжига, но более дисперсной (тоньше пластинки ферритоцементитной смеси).
Цель нормализации доэвтектоидных и эвтектоидных сталей та же, что и полного отжига. Однако после нормализации твердость и прочность стали выше, чем после полного отжига. Нормализация применяется обычно для исправления структуры перегретой и литой стали, измельчения зерна, смягчения стали перед обработкой и резанием, подготовки к закалке, устранения сетки вторичного цементита в заэвтектоидной стали [7]. Нормализация, по сравнению с отжигом, – более экономичная операция, так как не требует длительного охлаждения вместе с печью.
Закалка стали применяется для значительного повышения прочности и твердости материала. Закалка производится нагреванием на 30 – 50 градусов выше температур, соответствующих линии аустенитного превращения (GSK) диаграммы состояния Fe – C (рис. 3.12); затем осуществляется выдержка в течение необходимого времени. Охлаждение после закалки проводится с высокой скоростью 100 – 500 град/с. Основным и решающим фактором, определяющим структуру и физико-механические свойства закаленной стали, является именно скорость охлаждения.
Особое значение для закалки имеет скорость охлаждения в интервале температур, где аустенит менее всего устойчив (650 – 550 °С). Обычно этот интервал температур при закалке необходимо пройти быстро. Важное значение имеет скорость охлаждения и в интервале температур 300 – 200 °С, когда во многих сталях происходит образование мартенсита. В этом интервале требуется более медленное охлаждение во избежание возникновения напряжений и закалочных трещин.
На практике применяют следующие охлаждающие среды: вода, 10 %-е растворы NaCl, H2SO3, Na2CO3 в воде, машинное масло, трансформаторное масло, эмульсия масла в воде, мыльная вода, керосин, воздух.
Углеродистые стали, имеющие высокую критическую скорость закалки, охлаждают (закаливают) в воде, а легированные стали, имеющие более низкую критическую скорость закалки, охлаждают в масле, где охлаждение происходит медленнее. Недостатком масла как охлаждающей среды являются его легкая воспламеняемость и относительно высокая стоимость. С понижением температуры охлаждающей среды закалка стали становится более резкой.
Существуют следующие способы закалки: в одном охладителе; в двух средах; с подстуживанием (перед погружением в охладитель материал некоторое время выдерживают на воздухе); ступенчатая; изотермическая закалка и др.
Существует метод поверхностной закалки – нагревание за счет теплового действия тока, индуцируемого в поверхностных слоях материала при помещении его в электромагнитное поле высокой частоты.
Кроме высоких прочности и твердости, закаленная сталь приобретает и повышенную хрупкость.
Отпуском называют нагрев закаленной стали до температуры ниже критической точки Ас1 с выдержкой при этой температуре и с последующим сравнительно медленным охлаждением на воздухе. Целью отпуска являются частичное или полное устранение внутренних напряжений, снижение твердости и повышение вязкости.
Отпуск является заключительной операцией термической обработки стали. Основными факторами, влияющими на свойства стали после отпуска, являются температура нагрева и продолжительность выдержки. В зависимости от значения температуры отпуск разделяют на низко- и высокотемпературный.
Цель низкотемпературного отпуска, проводимого при 150 – 250 °С, – уменьшение внутренних напряжений в закаленной детали без снижения твердости. Отпуск проводят в масляных или солевых ваннах. Низкотемпературный (низкий) отпуск называют также отпуском на мартенсит.
Среднетемпературный (средний) отпуск – отпуск на троостит – происходит при нагреве до температур 350 – 450 °С. При этом снижается твердость стали.
Высокотемпературный (высокий) отпуск – отпуск на сорбит – производится при температуре 500 – 650 °С. Применяют в машиностроении для изделий из конструкционной стали с целью обеспечения достаточной прочности, вязкости и пластичности. Сочетание закалки с высоким отпуском на сорбит называется улучшением стали. Эту операцию применяют для среднеуглеродистых сталей (0,35 – 0,60 % С).
Химико-термическая обработка стали – это процесс, представляющий собой сочетание термического и химического воздействия с целью изменения состава, структуры и свойств поверхностного слоя стали.
При химико-термической обработке протекают следующие процессы [7]: распад молекул во внешней среде и образование атомов диффундирующего элемента (диссоциация); поглощение атомов поверхностью стали (адсорбция); проникновение атомов в глубь стали (диффузия).
Химико-термическая обработка позволяет получить стальную деталь с твердым поверхностным слоем и мягкой сердцевиной.
Диффузионное насыщение поверхности деталей проводят различными элементами: углеродом, азотом, хромом, кремнием, бором и др.
Цементация – процесс химико-термической обработки, представляющей собой диффузионное насыщение поверхностного слоя стали углеродом. В поверхностном слое содержание углерода составляет 0,8 – 1,0 %.
Цементацию проводят в твердых, жидких и газообразных средах, называемых карбюризаторами. В качестве твердого карбюризатора применяют древесный уголь с добавлением углекислых солей (ВаСО3, Na2CO3 и др.). Жидкие карбюризаторы (смесь цианистого калия с бурой, содой и другими веществами) применяют в случаях, когда нужно получить тонкий цементированный слой с высоким содержанием углерода. Газовую цементацию проводят при нагреве деталей до 900 – 950 °С в специальных герметически закрытых печах, в которые непрерывным потоком подают цементирующий углеродсодержащий газ (метан, бензол и др.).
Цементированные детали (зубчатые колеса, ролики подшипников и др.) подвергают термической обработке, наиболее часто – закалке при 820 – 850 °С и отпуску.
Азотирование – процесс химико-термической обработки, представляющий собой диффузионное насыщение поверхностного слоя стали азотом. Цель азотирования – получение поверхности деталей высокой твердости и износостойкости или устойчивости против коррозии (антикоррозионное азотирование) [7].
Для азотирования детали нагревают (при 500 – 700 °С) в специальной герметически закрытой печи, через которую пропускают аммиак NH3. Образовавшийся свободный азот, находящийся в атомарном состоянии, воздействует на сталь и образует с элементами, входящими в ее состав (Fe, Cr, Al), нитриды, придающие поверхностному слою очень высокую твердость. Недостаток азотирования – длительность процесса (до 90 ч). Азотированию подвергают цилиндры моторов и насосов, зубчатые колеса, штампы, пуансоны и др. Антикоррозионному азотированию подвергают в основном углеродистые стали при 600 – 700 °С с выдержкой в течение 0,5 – 1 ч.
Поверхностное насыщение стали одновременно углеродом и азотом в расплавленной цианистой соли называют цианированием, а в газовой среде – нитроцементацией. Цель этих процессов – получение высокой твердости и износостойкости поверхности деталей. Процессы проводятся при температуре 820 – 960 °С, их продолжительность 1,5 – 6,0 ч. Затем детали (широкой номенклатуры) охлаждают на воздухе, подвергают закалке и отпуску.
Борированием называется химико-термическая обработка, заключающаяся в диффузионном насыщении поверхностного слоя стали бором при нагревании в соответствующей среде. Обычно борирование выполняют при электролизе расплавленной буры (Na2B4O7), при этом стальное изделие является катодом. Процесс проводят при температуре 930 – 950 °С в течение 2 – 6 ч. В результате борирования износостойкость деталей возрастает в 2 – 6 раз.
Диффузионное насыщение металлами (алюминием, хромом и др.) и металлоидами (кремнием, бором и др.), называемое диффузионной металлизацией, проводят с целью повышения жаростойкости, коррозионной стойкости, твердости и износостойкости стальных деталей. Насыщение при 1000 – 1200 °С проводят в твердых, жидких и газовых средах.
Свойства, классификация и маркировка сталей
Как указывалось выше, сталью называют сплав железа с углеродом и другими элементами с содержанием углерода до 2,14 %
На свойства стали значительное влияние оказывают постоянные (нежелательные) примеси (сера, фосфор, газы), а также технологические добавки (кремний, марганец и др.). Примеси могут попадать в сплав из природных соединений и руд, а также при переработке металлолома. Основным элементом сплава, по отношению к которому все остальные элементы – примеси, является тот, чья атомная решетка определяет кристаллографическое строение всего сплава. Пока содержание элементов в стали таково, что кристаллографическое строение сплава определяется решеткой железа, сплав называется легированной сталью. Когда содержание элементов достигает таких значений, что строение сплава определяется решеткой добавочных элементов, а не железа, то говорят уже о сплаве (титановом, никелевом и др.).
Если сталь имеет в своем составе железо, углерод и некоторое количество постоянных примесей (S, P, Si, Mn, газы), то такую сталь называют углеродистой. Если в процессе выплавки углеродистой стали к ней добавляют легирующие элементы (Cr, Ni, W, Mo и др.), а также Mn и Si в повышенном количестве (более 0,8 – 1,0 %), то такую сталь называют легированной.
Углерод оказывает основное влияние на свойства углеродистой стали, находится в ее составе главным образом в связанном состоянии в виде цементита. В свободном состоянии в виде графита содержится в чугунах. С увеличением содержания углерода в стали повышаются ее твердость и прочность, уменьшаются пластичность и вязкость.
Сера является нежелательной примесью, образует с железом сульфид железа FeS, который находится в стали в виде эвтектики Fe – FeS с температурой плавления 985 °С.
При нагреве стали до температуры 1000 – 1200 °С для горячей обработки давлением эвтектика плавится, сера кристаллизуется на границах зерен, что приводит к нарушению связи между зернами, повышению хрупкости, разрушению при деформации вследствие образования внутренних трещин и надрывов. Это явление называют красноломкостью. Содержание серы в стали не должно превышать 0,06 %.
Фосфор растворяется в a- и g-Fe, искажает кристаллическую решетку и ухудшает пластичность стали. Фосфор вызывает явление хладноломкости, является нежелательной примесью, содержание которой в сталях должно быть менее 0,08 %.
Азот, кислород присутствуют в сплавах в составе оксидов, нитридов – хрупких неметаллических соединений (включений), которые создают дефекты кристаллической структуры. Они являются концентраторами напряжений и могут понизить механические свойства (прочность, пластичность).
Водород поглощается сталью в атомарном состоянии. При охлаждении сплава растворимость водорода снижается, он накапливается в микропорах под высоким давлением. Это может привести к образованию в материале внутренних надрывов (флокенов).
Марганец и кремний – полезные примеси. Их добавляют в сталь при выплавке. Марганец существенно снижает красноломкость стали, образует пластичный MnS с температурой плавления 1620 °С. Марганец увеличивает твердость, прочность и износостойкость стали, при его содержании более 1,5 % снижается пластичность стали.
Кремний связывает закись железа (FeO) с образованием силикатов (FeO×SiO2), которые удаляются вместе со шлаками. Кроме того, кремний понижает склонность стали к хладноломкости, способствует получению более однородной структуры, положительно сказывается на упругих характеристиках. Кремний способствует изменению магнитных свойств стали, а при содержании его в количестве 15 – 20 % придает материалу кислотоупорность.
Обычное содержание кремния в углеродистой стали – не более 0,4 %, марганца – 0,8 %.
Стали классифицируют по химическому составу, качеству и назначению. По назначению стали подразделяются на конструкционные, инструментальные, стали с особыми физико-химическими свойствами. По химическому составу различают стали углеродистые и легированные.
Конструкционные стали применяют для изготовления деталей машин и конструкций; инструментальные – режущих, измерительных инструментов, штампов и т.д. К сталям и сплавам с особыми свойствами относят жаропрочные, коррозионно-стойкие, магнитные и др. Они нашли широкое применение в приборостроении, в том числе в медицинской технике.
По качеству различают стали обыкновенного качества, качественные, высококачественные и особо высококачественные. При этом учитываются способ выплавки и содержание серы и фосфора. Стали обыкновенного качества имеют повышенное содержание нежелательных примесей – до 0,06 % серы и до 0,08 % фосфора, их механические свойства ниже, чем у сталей других групп. Качественные стали содержат серу и фосфор в концентрации менее 0,035 % каждого элемента. Высококачественные стали, выплавляемые в электропечах, содержат менее 0,025 % и серы, и фосфора. Особо высококачественные стали, подвергнутые электрошлаковому переплаву с вакуумированием, содержат серу и фосфор в концентрации, не превышающей 0,015 %.
Углеродистые стали
В зависимости от содержания углерода стали делятся на низкоуглеродистые с содержанием углерода 0,09 – 0,25 %, среднеуглеродистые с содержанием 0,25 – 0,60 % углерода и высокоуглеродистые с содержанием более 0,60 % углерода.
Стали обыкновенного качества являются наиболее дешевыми и широко применяются в тех случаях, когда к материалу не предъявляются повышенные требования. По сравнению с качественными сталями они содержат больше серы, фосфора, неметаллических включений вследствие менее тщательной очистки в процессе выплавки. Из углеродистых сталей обыкновенного качества изготавливают балки, прутки, листы, трубы; сварные, клепаные и болтовые конструкции (балки, фермы, детали подъемных кранов и др.); малонапряженные детали машин (оси, валы, шестерни, втулки, валики, болты и др.). Детали машин часто упрочняются с помощью термической обработки.
Марки углеродистой стали обыкновенного качества обозначаются буквами и цифрами, например Ст0, …, Ст6, БСт0,…, БСт6, ВCт0, …, ВСт6. Буквы Ст обозначают сталь, цифры от 0 до 6 – условный номер марки в зависимости от химического состава и механических свойств. Чем больше число, тем больше содержание углерода в стали, выше прочность и ниже пластичность.
В зависимости от гарантируемых химического состава и свойств углеродистые стали обыкновенного качества делят на три группы: А, Б, В (группа А в марке стали не указывается). Сталь группы А имеет гарантированные механические свойства и не подвергается горячей обработке. Для стали группы Б гарантируется химический состав, сталь подвергается обработке давлением; для стали группы В гарантируются химический состав и механические свойства (используется для сварных конструкций).
К углеродистым качественным конструкционным сталям предъявляются повышенные требования по химическому составу и механическим свойствам. Эти стали выплавляются кислородно-конвертерным способом в мартеновских или электропечах.
Качественные углеродистые стали маркируют цифрами: 05, 08, 10, 15, 20, …, 85, которые указывают среднее содержание углерода в сотых долях процента. Такие стали делят на несколько групп.
Низкоуглеродистые качественные стали 05, …, 10 (без термической обработки) хорошо обрабатываются давлением в холодном состоянии вследствие их высокой пластичности, а также хорошо свариваются из-за малого содержания углерода. Они используются для производства малонагруженных деталей машин и сварных конструкций.
Стали 15, 20, 25, составляющие вторую группу низкоуглеродистых качественных сталей, хорошо свариваются и обрабатываются резанием. Их применяют без термической обработки или в нормализованном состоянии для изготовления неответственных деталей машин, после цементации – деталей с повышенной износостойкостью (кулачковые валики, кронштейны и др.).
Самой значительной является группа среднеуглеродистых сталей 30, 35, 40, 45, 50, подвергающихся термической обработке. Они хорошо обрабатываются на металлорежущих станках в отожженном состоянии. Сочетание высоких прочностных и пластических свойств позволяет применять эти стали для изготовления ответственных деталей машин (шпиндели, распределительные валы и др.).
Высокоуглеродистые стали 60, 65, 70, 75, 80 и 85 подвергаются различным видам термической обработки, в результате чего приобретают высокую прочность, износостойкость и упругие свойства. Применяются для изготовления пружин, рессор, замковых шайб и др.
Углеродистые инструментальные стали маркируют следующим образом: впереди ставят букву У, затем цифру – среднее содержание углерода, выраженное в десятых долях процента. Например, сталь марки У9 содержит в среднем 0,9 % С, сталь У11 – 1,1 % С.
Для обозначения высококачественных сталей в конце марки ставится буква А, а особо высококачественных сталей (выплавленных, например, методом электрошлакового переплава с вакуумированием) – буква Ш. В марках некоторых специальных сталей буква впереди указывает на назначение: А – автоматная сталь (А30), Р – быстрорежущая сталь (Р12) и др.
Легированные стали
Легированными называют стали, в которых, кроме железа, углерода, случайных примесей и технологических добавок, содержатся легирующие элементы для придания сталям специальных свойств. Основными легирующими элементами являются марганец, кремний, хром, никель, вольфрам, молибден и др.
Легированные стали делят на низколегированные с общим содержанием легирующих элементов до 2,5 %, среднелегированные – 2,5 – 10,0 % и высоколегированные – более 10 %.
Основной целью легирования является изменение строения стали и ее физико-механических свойств. Легированием можно повысить твердость стали, сопротивление износу и коррозии и т.д. В зависимости от входящих в состав сталей легирующих элементов их называют хромистыми, хромоникелевыми, ванадиевыми и т.п.
Влияние легирующих элементов на свойства стали определяется их концентрацией и особенностями взаимодействия с железом и углеродом. При взаимодействии с железом легирующие компоненты обычно образуют твердые растворы или химические соединения, а при взаимодействии с углеродом находятся в связанном или свободном состоянии.
При образовании твердых растворов замещения железа с легирующими компонентами возможна как полная (Ni, Co), так и ограниченная растворимость (Cr, W, Mo). Если введенное в сталь количество примесей превышает предел растворимости, то избыток образует с железом химические соединения: FeCr, Fe3W2, Fe3Mo2 и т.д. При образовании твердых растворов изменяются все свойства исходного материала, особенно физические и механические. При образовании механических соединений изменяются, главным образом, механические свойства стали.
Легирующие компоненты Mn, Cr, W, Mo, V, Ti, Nb, Ta, Zr и др. образуют с углеродом устойчивые карбиды Mn3C, Cr4C3, WC2, Mo2C, VC, TiC, NbC, TaC, ZrC, повышающие предел прочности и твердость стали. Все легирующие компоненты, за исключением Мn, при нагревании стали задерживают рост зерна аустенита, что позволяет подвергать легированные стали обработке давлением, не опасаясь перегрева.
Легирующие элементы оказывают влияние и на другие свойства стали: Ni, V, Co повышают вязкость; Mn, Ni, Cr увеличивают стойкость к истиранию; Ni, Cr, Cu, Si, Mo и др. повышают коррозионную стойкость.
По структуре легированные стали в отожженном состоянии разделяют на следующие группы: доэвтектоидные (содержащие избыточный феррит), эвтектоидные (имеющие перлитную структуру), заэвтектоидные (в структуру входят избыточные вторичные карбиды) и ледебуритные (составной частью структуры являются первичные карбиды).
По структуре в нормализованном состоянии легированные стали делят на три класса:
1) перлитные (содержание легирующих компонентов – до 5 %);
2) мартенситные (содержание легирующих компонентов от 5 до 13 %);
3) аустенитные (содержание легирующих компонентов – до 20–30 %).
Наиболее распространенными являются легированные стали доэвтектоидные, эвтектоидные и перлитные, к которым относятся низко- и среднелегированные конструкционные и инструментальные стали. Стали мартенситные, ферритные, ледебуритные и заэвтектоидные являются высоколегированными.
Качественные, высококачественные и особо высококачественные стали маркируют следующим образом. Содержание углерода указывают в начале марки цифрой, соответствующей его содержанию в сотых долях процента для конструкционных сталей и в десятых долях процента для инструментальных сталей.
Легирующие элементы указывают русскими буквами: марганец – Г, кремний – С, хром – Х, никель – Н, вольфрам – В, ванадий – Ф, титан – Т, молибден – М, кобальт – К, алюминий – Ю, медь – Д, бор – Р, ниобий – Б, цирконий – Ц, азот – А.
Цифры, следующие после букв, указывают содержание легирующего элемента в целых процентах; отсутствие цифры указывает на то, что сталь содержит менее 1,5 % указанного элемента. Исключением являются вольфрам и молибден.
Для высококачественных конструкционных сталей в конце марки ставят букву А. Например, сталь 12Х2Н4 – качественная конструкционная с содержанием 0,12 % углерода, 2 % хрома и 4 % никеля; сталь 12Х2Н4А – высококачественная такого же состава. В конце марки стали особо высокого качества (электрошлакового переплава) стоит буква Ш.
Все стали инструментальные легированные и с особыми свойствами всегда высококачественные, поэтому в конце марки этих сталей буква А не ставится.
Легированные конструкционные стали делят на цементируемые, улучшаемые и высокопрочные.
Для тяжело нагруженных деталей небольших размеров (зубчатые колеса, оси и др.) применяют низкоуглеродистые цементируемые легированные стали марок 20Х, 12Х2Н4А и др. После цементации, закалки в воде и низкого отпуска поверхность деталей приобретает высокую твердость, а сердцевина не упрочняется.
Улучшаемые среднеуглеродистые легированные стали – это стали, подвергаемые улучшению путем термической обработки, состоящей в закалке с 820 – 880 °С в масле с последующим высоким отпуском (550 – 650 °С). Для тяжело нагруженных деталей больших размеров применяют легированные стали марок 40ХН, 30ХГСА и др.
Для деталей с высоким пределом прочности (sВ=1500–2500 МПа) используют высокопрочные стали на основе железа, легированного никелем, кобальтом, титаном, молибденом, хромом и другими элементами марок Н12К15М10, Н18К9М5Т и др. Такие стали называются мартенситностареющими, их закаливают с 800 – 860 °С на воздухе с последующим старением при 450 – 500 °С. Применяют их для особо ответственных тяжело нагруженных деталей.
К конструкционным легированным сталям относятся также износостойкие, рессорно-пружинные, шарикоподшипниковые и др.
Основными свойствами инструментальных легированных сталей являются твердость, вязкость, износостойкость, теплостойкость (красностойкость), прокаливаемость. Инструментальные стали делят на углеродистые (рассмотренные ранее), легированные и быстрорежущие.
Инструменты из легированных сталей после закалки, как правило в масле, и низкого отпуска имеют высокую твердость, отличаются повышенной вязкостью, меньшей склонностью к деформациям и трещинообразованию при закалке. Из легированных инструментальных сталей марок 9ХС, ХВГ, В1, ХВ5 и других изготавливают различные режущие инструменты, имеющие сложную конфигурацию.
При изготовлении штампов для горячей обработки металлов применяют легированные инструментальные стали сложного состава: 4Х2В5ФМ, 4Х3ВФ2М2, 3Х2В8Ф и др.
Быстрорежущие стали широко используют для изготовления режущего инструмента, обладающего большой твердостью и работающего при высоких скоростях резания. Быстрорежущая сталь относится к ледебуритному (карбидному) классу сталей. В ее состав входят карбидообразующие элементы – хром, вольфрам, ванадий, кобальт, молибден.
Высокие режущие свойства инструментов, изготовленных из быстрорежущих сталей марок Р6, Р9, Р12, Р18 (цифра после буквы показывает среднее содержание вольфрама в процентах), получают после закалки с температуры 1210 – 1290 °С в зависимости от марки стали с последующим отпуском. Режущие свойства инструментов повышают также с помощью цианирования.
Электро- и теплопроводность металлов и сплавов
Электропроводность металлов
Классическая электронная теория металлов представляет твердый проводник в виде системы, состоящей из узлов кристаллической ионной решетки, внутри которой находится электронный газ из коллективизированных свободных валентных электронов. К электронному газу применялись представления и законы обычных газов. Это привело к выводу законов Ома и Джоуля – Ленца, позволило описать и объяснить ранее обнаруженные экспериментальным путем основные законы электропроводности и потерь электрической энергии в металлах.
Однако исчерпывающее объяснение явлений электропроводности оказалось возможным на основе квантовой механики. В соответствии с квантово–механическими представлениями причиной наличия электрического сопротивления твердых тел является не столкновение свободных электронов с атомами решетки (как в классической теории Друде), а рассеяние их на дефектах решетки, вызывающих нарушение периодичности потенциала. Идеально правильная, бездефектная неподвижная решетка не способна рассеивать свободные носители заряда и поэтому должна обладать нулевым сопротивлением.
Подвижность и длина свободного пробега электронов в твердом теле зависят от структуры материала. Чистые металлы с наиболее правильной кристаллической решеткой характеризуются наименьшими значениями удельного сопротивления r. Примеси, искажая решетку, приводят к увеличению r. С позиций квантовой механики рассеяние электронных волн происходит на дефектах кристаллической решетки, которые соизмеримы с расстоянием порядка четверти длины волны электрона; нарушения меньших размеров не вызывают заметного рассеяния волн де Бройля. В металлическом проводнике, где длина волны электрона порядка 5 Å, микродефекты создают значительное рассеяние, уменьшающее подвижность электронов и длину свободного пробега, и, следовательно, приводят к росту r.
Так как в металлах концентрация электронного газа n практически не зависит от температуры (Т), то зависимость удельного сопротивления r (и обратной величины удельной электропроводности s) от температуры полностью определяется температурной зависимостью подвижности (m) и пропорциональной ей длины свободного пробега электронов (l).
Вследствие усиления колебаний узлов кристаллической решетки с ростом температуры появляется все больше и больше препятствий на пути направленного движения свободных электронов под действием электрического поля, т.е. уменьшается среднестатистическая длина свободного пробега l, уменьшается подвижность электронов и, как следствие, уменьшается удельная проводимость металлов и возрастает удельное сопротивление (рис. 3.14).

Рис. 3.14. Зависимость удельного сопротивления металлов и сплавов от температуры: 1 – железо; 2 – электротехническая сталь с содержанием 4 % Si; 3 – сплав Fe-Ni-Cr
Удельное сопротивление сплавов
Как указывалось, примеси и нарушения правильной структуры металлов ведут к увеличению их удельного сопротивления.
Значительное возрастание r наблюдается при сплавлении двух металлов в том случае, если они образуют твердый раствор, т.е. создают при отвердевании совместную кристаллизацию, и атомы одного металла входят в кристаллическую решетку другого.
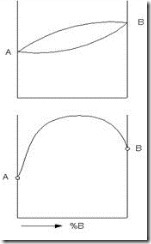
Зависимость удельного сопротивления сплава двух металлов, образующих твердый раствор, от процентного содержания каждого из них представлена на рис. 3.15 (кривая а). Кривая имеет максимум, соответствующий некоторому соотношению содержания компонентов в сплаве; при уменьшении содержания каждого из них r падает, приближаясь к соответствующим значениям r чистых металлов. Обычно наблюдается определенная закономерность и в изменении ТКr (ТК – температурный коэффициент): относительно высокими значениями ТКr обладают чистые металлы, а у сплавов ТКr меньше и даже может приобретать небольшие по абсолютной величине отрицательные значения (рис. 3.15, кривая б). Это объясняется тем, что у сплавов изменение r вызывается не только изменением подвижности носителей заряда, но в некоторых случаях и возрастанием концентрации носителей при повышении температуры.
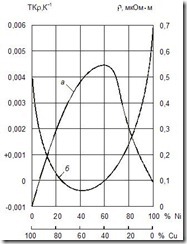
Рис. 3.15. Зависимость r (а) и ТКr (б) сплавов системы Cu-Ni от состава (в процентах по массе)
Теплопроводность
Тепло через металл передается в основном теми же свободными электронами, которые определяют и электропроводность металлов; количество их в единице объема металла весьма велико. Поэтому, как правило, коэффициент теплопроводности h металлов много больше, чем у диэлектриков. Очевидно, что при прочих равных условиях чем больше удельная электрическая проводимость s металла, тем больше его коэффициент теплопроводности h. При повышении температуры, когда подвижность электронов в металле и соответственно его удельная проводимость s уменьшаются, отношение коэффициента теплопроводности металла к его удельной электрической проводимости h/s должно возрастать. Математически это выражается законом Видемана – Франца – Лорентца:
h/s = L0T, (3.1)
где Т – абсолютная температура, К; L0 – число Лорентца, равное
 . (3.2)
. (3.2)
Подстановка в (3.2) значений постоянной Больцмана k = 1,38×10-23 Дж/К и заряда электрона e = -1,6×10-19 Кл дает L0 = 2,45×10-8 В2/К2.
Закон Видемана – Франца – Лорентца для большинства металлов хорошо подтверждается при температурах, близких к нормальной или несколько повышенных.
Проверим справедливость этого закона для меди при нормальной температуре. Подставляя в формулу (3.1) параметры меди: s = 57×106 См/м и h= 390 Вт/(м×К), получаем (при Т = 293 К) L0 = 2,54×10-8 В2/К2, что весьма близко к теоретическому значению. При нормальной температуре для алюминия L0 = 2,1×10-8, для свинца и олова – 2,5×10-8, для железа – 2,9×10-8 В2/К2.
Однако в области низких температур коэффициент при Т в уравнении (3.1) уже не остается неизменным: так, для меди при охлаждении он проходит через минимум, а при приближении к абсолютному нулю вновь близок к теоретическому значению L0.